
Для развития производственных аптек необходимо решить проблему доступности фармсубстанций в малых фасовках. Минздрав предложил регистрировать субстанции специально для экстемпоральных лекарств. Еще одна проблема — отсутствие спроса со стороны медицинских организаций.

Фото: loft39studio/ru.123rf.com
Повышение доступности фармсубстанций, включенных в государственный реестр для реализации, а также вспомогательных веществ по востребованной номенклатуре в малых фасовках — это один из вопросов, который волнует производственные аптеки. Об этом на заседании рабочей группы по производству экстемпоральных препаратов Госдумы заявил депутат Айрат Фаррахов, передает корреспондент «ФВ».
Как добыть субстанции
Производственным аптекам не хватает ассортимента фармсубстанций, вторая проблема — большие фасовки, считает заместитель заведующего лабораторией регуляторных отношений Санкт-Петербургского химфармуниверситета Дмитрий Юрочкин.
«Большая фасовка зачастую приводит к нерентабельности, производственная аптека не успевает в течение определенной степени использовать данные фармацевтические субстанции и вынуждена их утилизировать», — отметил он.
Юрочкин считает, что необходимо стимулировать фармацевтических производителей включать субстанции в реестр как Евразийского экономического союза, так и в национальный, так как производственные аптеки могут изготавливать именно из фармацевтических субстанций, которые включены в реестр, либо из зарегистрированных лекарственных препаратов.
Замминистра здравоохранения Сергей Глаголев отметил, что после вступления в силу законодательства ЕАЭС о едином стандарте регистрации лекарственных средств, которое ввело достаточно широкие требования к качеству как фармацевтических субстанций, так и лекарственных препаратов, снизилось количество регистрируемых фармсубстанций.
При этом выросло количество лекарственных препаратов, которые выпускаются серийно на производстве. «Этот феномен связан в том числе с тем, что широкая индустрия низкомаржинальных дженериков, производимых с использованием зарубежных субстанций, при посредстве поставок трейдеров, сегодня уступает место локализации, сегментации этого рынка и развитию производства субстанций по полному циклу. Исходя из логики Евразийского экономического союза, мы регистрируем большинство субстанций в составе лекарственных препаратов, и имеются четкие регуляторные ограничения на выдергивание этой субстанции из досье и начало его свободной реализации», — пояснил замминистра.
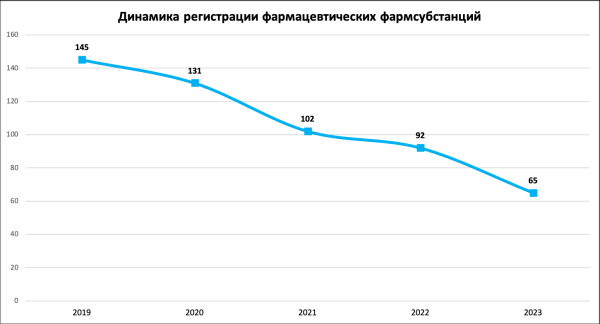
Источник: ГРЛС
Он добавил, что фармацевтические субстанции, которые используются в производственных аптеках, должны регистрироваться как самостоятельные продукты. То есть должен быть заявитель регистрации, «налаженный институт выпуска той или иной серии в обращение, на основе протоколов анализа, подписанных уполномоченным по качеству».
По словам Глаголева, необходимо выяснить запрос производственных аптек на необходимую номенклатуру фармсубстанций, чтобы индустрия производителей субстанций понимала, какие продукты требуются для аптек. «Исходя из этого, мы тоже проведем работу с Минпромторгом по активизации регистрации данных продуктов», — заключил Глаголев.
Вопрос малых объемов субстанций, по его словам, можно решить путем делегирования производственным аптекам фасовки для последующей перепродажи другим производственным аптекам.
При этом понадобится решить вопросы обеспечения качества, входного и выпускающего контроля, установления срока годности.
Кому нужны производственные аптеки
Второй вопрос, который обсуждался на заседании, — обеспечение спроса на лекарства, изготовленные в аптеках. «Проблема в том, что врачи разучились подписывать рецепты, и у нас все информационные медицинские системы вообще не нацелены на работу с рецептурой», — заявил руководитель Ассоциации государственных аптек Павел Ястребов. При этом спрос на такие препараты у некоторых врачей все же есть.
Директор по экономике здравоохранения «Р-Фарм» Александр Быков отметил, что клинические рекомендации не содержат указаний на то, чтобы можно было назначать индивидуально изготовленные лекарственные препараты, поэтому это не компенсируется ни ОМС, ни другими источниками финансирования. Если Росздравнадзор будет проверять, то несоблюдение клинических рекомендаций будет рассматриваться как несоблюдение требований по обеспечению качества медицинской помощи.
Председатель правления Союза фармацевтических и биомедицинских кластеров Захар Голант полагает, что необходимо развивать спрос на экстемпоральную рецептуру. «Если очень-очень грубо, везде, где сейчас написано зарегистрированный лекарственный препарат, должна появиться запятая, у нее должна появиться экстемпоральная лекарственная форма. Это должно происходить и в системе тарифов, и в системе льготного лекарственного обеспечения», — сказал он.
Источник: pharmvestnik.ru